- 科研动态
- Research Dynamics



继上期我们了解了会“隐身”的两性离子聚合物这种神奇的高分子材料,这种高分子材料在生物医学领域具有丰富的应用前景。本期#技术领域解析,将为您介绍另一种在生物医学领域具有广泛用途的材料—层状双金属氢氧化物。内容精彩,不容错过!

层状双金属氢氧化物( layered double hydroxides,LDHs)是一种主客层材料,是一类由两种或两种以上金属元素组成的金属氢氧化物,结构由主层板和层间的阴离子及水分子相互交叠构成[1]。
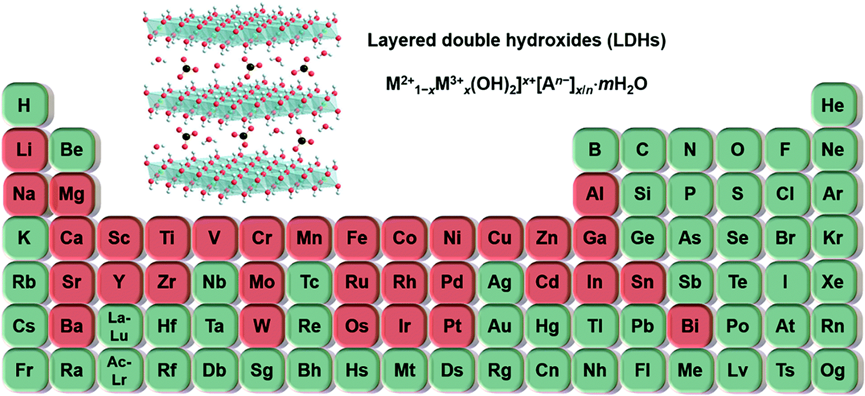
LDHs结构示意图(顶部)和周期表(底部)。已报道的进入或锚定在LDH层上的金属元素以红色突出显示[2]。
如图所示,LDHs的化学式一般描述为[M1-x2+ Mx3+(OH)2]x+[An-]x/n·mH2O,其中M2+(例如Mg2+、Ca2+、Mn2+、Fe2+、Co2+、Ni2+、Cu2+或Zn2+)和M3+(例如Al3+、 Cr3+、Mn3+、Fe3+、Co3+、 Ga3+、In3+或Gd3+)代表位于主板层的二价和三价金属阳离子,An-代表存在于层间区域的可交换阴离子(例如NO3-、CO32-、Cl-等),用于中和层的正电。X由M3+/(M2+ + M3+)摩尔比决定。通过改变金属阳离子的类型、电荷和比例、层间阴离子的电荷和方向以及水分子的相对含量,可以对LDHs的化学组成、晶体结构、尺寸、形态、层间间距和阴离子交换能力进行调整。

▷ 1842年,Hochstetter首次从片岩中发现了天然水滑石矿物[3]。
▷ 1942年,Feitknecht等人通过金属盐溶液与碱金属氢氧化物的反应,首次人工合成了MgAl-LDHs,并提出了一个层状结构模型[4]。
▷ 20世纪70年代和80年代,Miyata等人对MgAl-LDHs的结构进行了详细研究,并对其作为一种新型催化剂的应用进行了探索[5]。
▷ 20世纪90年代,人们应用现代分析技术对LDHs的结构和性质进行了更详细的研究,充分揭示了其层状结构的灵活性和可变性。
▷ 1994年,段等人率先开展了工程和产业化研究,实现了结构创新,突破了关键制备技术[6]。1999年,他们进一步发现了LDHs的插入特性,并成功构建了一系列基于LDHs的具有超分子插入结构的先进功能材料[7]。
▷ 自20世纪中期以来,LDHs由于其特殊的层状结构、可调化学成分和吸引人的物理化学性质,在各种应用领域被广泛探索,包括光学、能源存储和转换、环境修复和催化。
▷ 21世纪初,LDHs作为抗酸剂和抗胃蛋白酶药物的活性成分第一次应用于生物医学应用。从那时起,LDHs被广泛应用于生物医学领域。
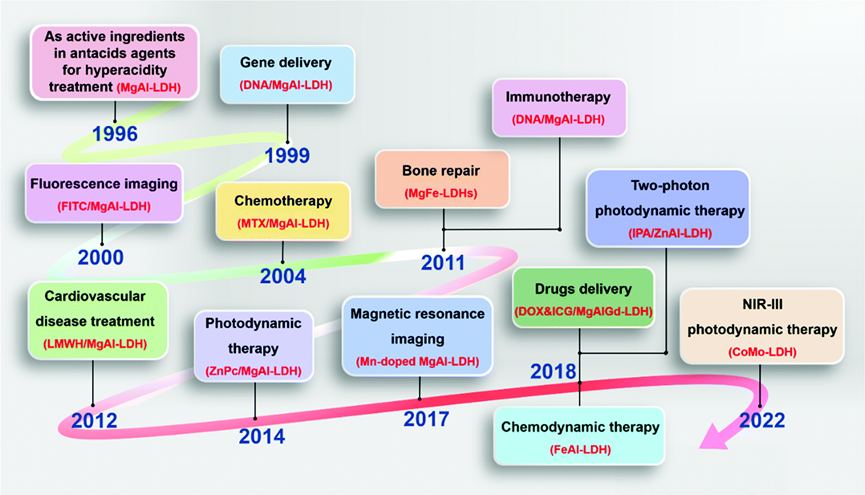
LDH在各种生物医学应用中的图示,按时间顺序排列

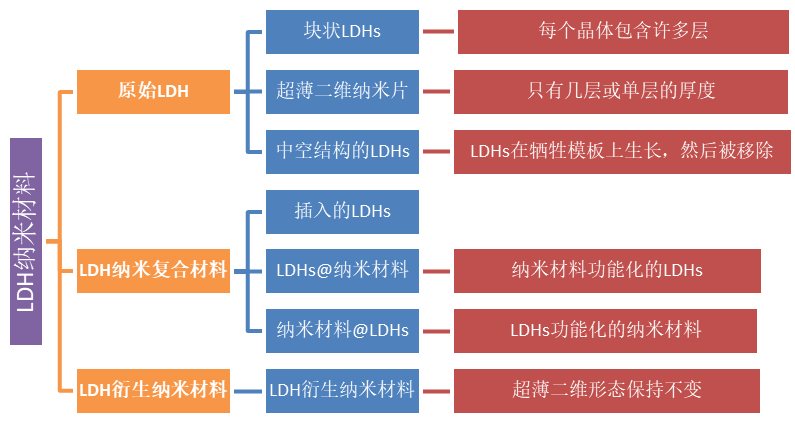
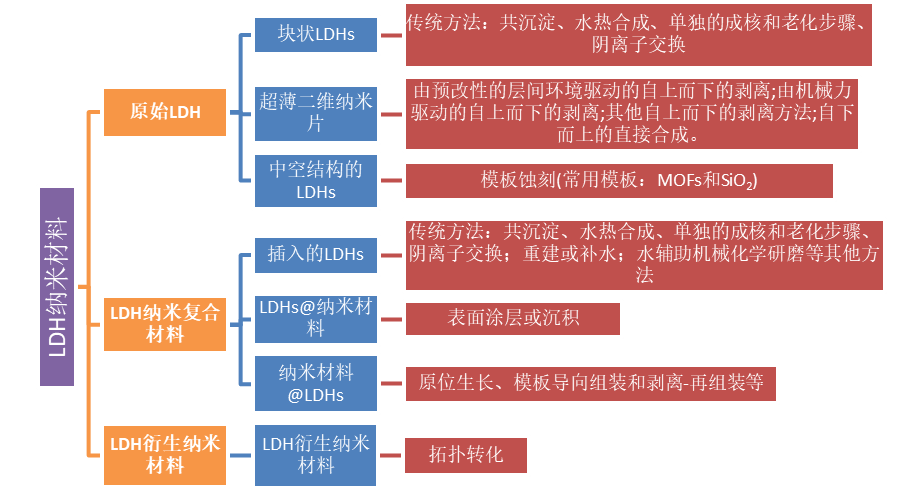
根据其组成部分,LDH基纳米材料可分为三类:原始LDHs、LDH基纳米复合材料和LDH衍生纳米材料。具体分类如下图所示:
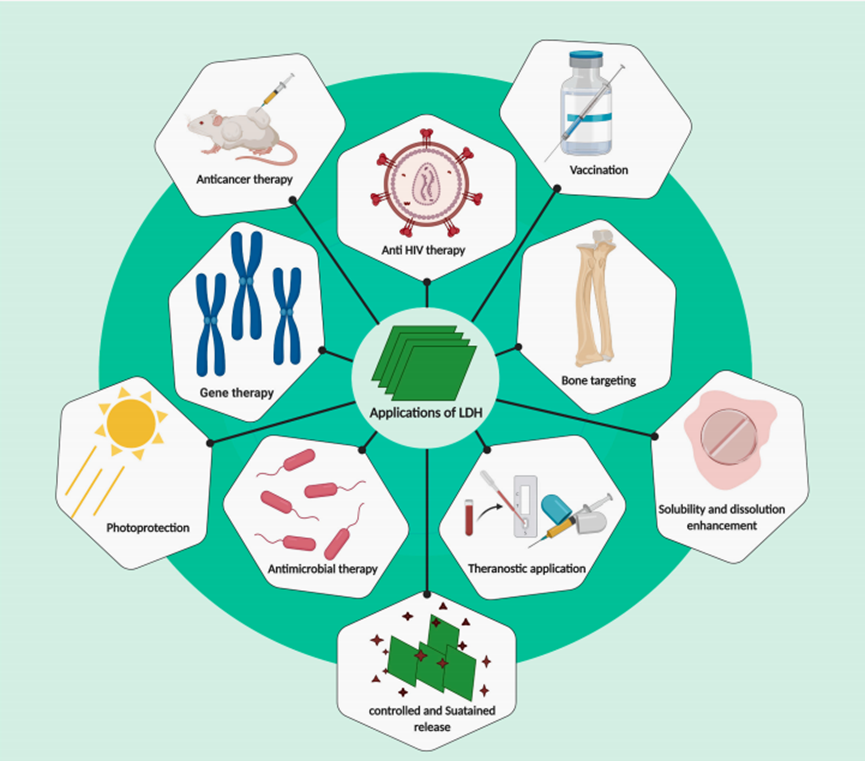
LDHs在生物医学应用方面具有的优势:
① LDHs具有高生物相容性和低细胞毒性。例如,MgAl-LDH是商用抗胃病口服药的主要成分之一,证明了LDH在体内的良好生物安全性。
② LDHs的插入特性以及可调节的层间间距(0.73-2.28 nm)和高比表面积(100-600m2g-1)使它们能够装载多种功能分子。LDHs的颗粒尺寸和/或层间间距可以通过功能分子的插入来调整,这可能会改变其性质和/或优化其在特定应用中的性能。
③ LDHs的封闭效应可以显著提高插层分子的治疗性能,稳定性和分散性,避免生物、化学和物理环境造成的破坏。
④ LDHs的正电荷有利于与带负电荷的药物共轭,类水滑石层丰富的羟基可以通过氢键进一步增加药物负载。此外,带正电荷的LDHs可以很容易地与带负电荷的细胞膜(或细菌膜)相互作用,使药物(或对细菌的杀菌剂)。在细胞内有效传递
⑤ LDHs具有酸敏感特性,可以在酸性环境中缓慢释放负载的药物分子。
⑥ LDHs的原料来源广、成本低、合成简单等特点使其生产容易达到吨级。此外,具有高比表面积的单层LDHs纳米片也已在实验室中大规模生产。
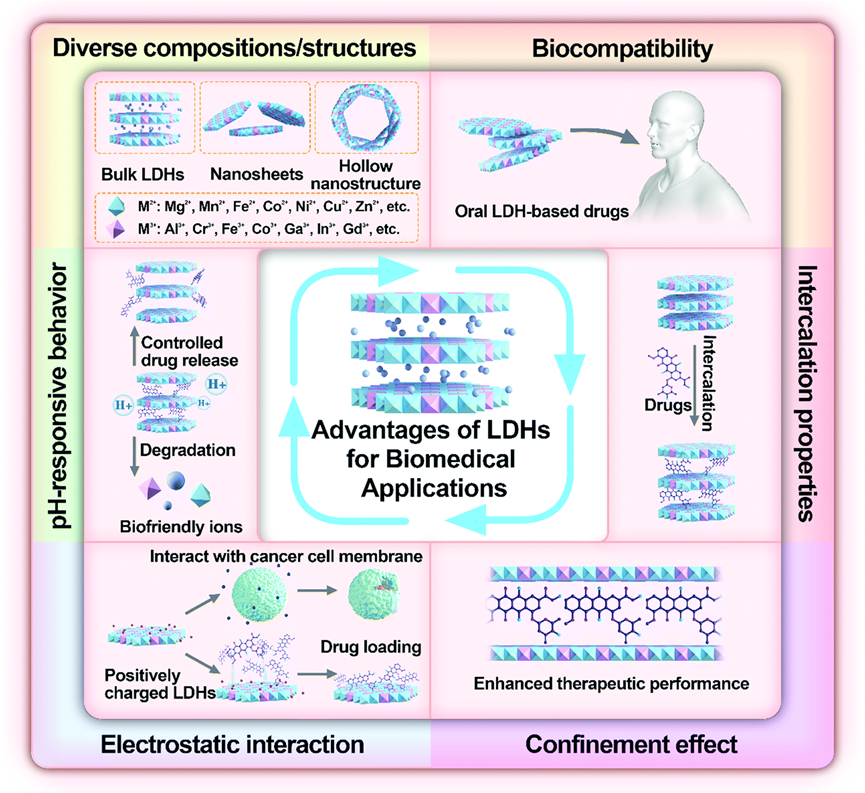
基于LDH的纳米材料在生物医学应用中的特性和优势示意图[2]

基于LDH的纳米材料可以通过不同的合成方法制备,以获得不同的结构(如形状、大小、厚度、结晶度)和物理化学性质(如光学和电子性质),并实现各种功能(如治疗、生物成像、生物传感、抗菌等)。
影响因素
一般来说,制备不同形态的LDHs涉及金属盐溶液与碱性溶液混合,受以下合成条件的影响:
(1)反应介质的pH值
(2)合成中使用的碱性溶液的浓度和性质
(3)反应温度和时间
(4)总金属阳离子浓度及其摩尔比
制备方法
表面改性
LDHs表面改性的目的一般有两个:
▷ 提高LDHs在生理环境下的稳定性和分散性。
▷ 丰富LDHs的功能。
一般来说,通过化学修饰来获得功能化的LDH基纳米材料主要通过两种策略实现:
▷ 非共价覆盖
LDH基纳米材料的表面可以通过非共价相互作用(静电相互作用、氢键和范德华力)被某些生物分子、荧光团或聚合物(如PEG和PVP)修饰,以调整其理化性质。
▷ 共价共轭
使用LDHs的羟基与所需基团上的特定官能团共价偶联,如靶向配体或荧光探针。

● 药物的控制释放
LDHs较大的比表面积和可调节的层间间距可以实现药物分子的高效负载。将药物插入LDHs可以保护药物分子在生理环境中的降解和失效,通过与LDHs层上的羟基作用提高其稳定性。LDHs的层状结构可使难溶药物进入以增加药物的溶解度,同时LDHs的表面/空间限制效应还可以减少药物分子的聚集,发挥最佳的治疗效果。LDHs能通过独特的“核内体逃逸”能力允许负载药物逃离核内体,从而保护药物保留其功能。LDHs的酸降解特性可以控制药物释放率,而且有利于药物的体内清除。
● 肿瘤成像
LDHs作为各种成像方式如FLI、MRI、CT、PET等潜在造影剂受到关注。LDHs的成像对比能力可以通过加载成像功能剂或改变层的金属元素来实现。目前,基于LDHs的ICAs(成像造影剂)可分为单模和多模ICAs。鉴于多种成像模式可以整合到单一的LDHs纳米平台上,因此可以合理地设计LDHs,使其表现出多种特征的组合,以获得比传统单模式成像对比剂更全面的生物信息。
● 癌症治疗
迄今为止,LDHs及其纳米复合材料已经在各种癌症治疗中得到了广泛的探索,包括传统化疗、新兴光疗法(光热疗法(PTT)和PDT)、基因治疗、免疫治疗、化学动力学治疗(CDT)和联合治疗。
● 治疗学
治疗学是一种将疾病的诊断或监测与治疗相结合的生物医学技术。许多基于LDH的多功能治疗纳米平台已经被开发出来,包括单成像模式治疗和多成像模式治疗。基于LDH的单模治疗试剂已成功应用于化疗、CDT、PDT和PTT。为了获得更准确和全面的成像诊断信息,多模式治疗技术也一直在开发中。
● 生物传感
目前,基于LDH的生物传感器的功能主要集中在检测传统的生物标志物,如过氧化氢、葡萄糖、多巴胺(DA)和蛋白质成分,具有以下特点:(1)带正电荷的LDHs可以与生物酶通过静电相互作用确保其均匀分布,提高它们的催化活性。(2) LDHs可以作为电催化剂、吸附剂以及固定生物分子或其他修饰剂的载体,以延长分析物与电极之间的作用时间。(3) LDHs具有良好的渗透性和孔隙率,可以提高分析物和其他反应产物的迁移率。(4) LDHs的中间层可为化学反应提供良好的微环境,保护其免受外界干扰。
● 抗菌应用
LDHs的pH敏感生物降解性和静电相互作用下驱动的细菌吸附能力,为制备高效抗菌剂奠定了坚实的基础。LDHs的抗菌机制包括:(1) LDHs本身作为抗菌剂。在LDHs和致病菌的相互作用过程中,LDHs中的具有抗菌活性的金属离子会随着菌层的溶解而缓慢释放,从而抑制细菌的生长和繁殖。同时,特定LDHs(如Zn-LDHs、Ti-LDHs)的光催化性能和表面的大量羟基也会导致ROS的产生,从而破坏细菌的生理结构。(2) LDHs作为抗菌剂载体。抗菌剂可以在层间空间或装载到LDHs表面,并从LDH载体持续释放,以达到理想的抗菌效果。
● 组织工程
LDHs在骨修复、伤口愈合、神经再生、牙齿修复和心脏修复等方面取得了重大成果。基于LDH的组织工程材料主要有两个功能:(1) LDH与支架材料的结合克服了原始支架材料生物活性不足的限制,可以在没有免疫排斥的情况下替代或修复人体组织。同时,通过调整LDHs中金属离子的组成,可以使复合支架具有成骨特性。(2)LDHs作为优秀的药物载体,可以实现药物/生长因子的持续释放,不仅延长了药物在人体组织中的作用时间,而且有效避免了药物突发释放引起的副作用。
LDH的生物医学应用[8]


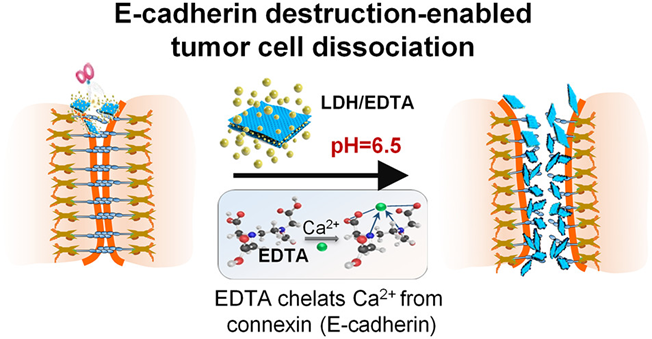
Nano Letters:钙粘蛋白E破坏引起的肿瘤细胞分离用于治疗低位结直肠癌
Low Colorectal Tumor Removal by E‑Cadherin Destruction-Enabled Tumor Cell Dissociation
结肠切除术带来的沉重的身体和心理负担、化疗中强烈的药物毒性以及骨髓抑制等给低位结直肠癌(CRC)的治疗带来了巨大的挑战。同济大学施剑林院士等人开发了一种安全且有效的基于肿瘤细胞分离的低位CRC治疗策略。将EDTA装载到层状双氢氧化物(LDH)纳米片中,制备了pH响应的LDH/EDTA纳米片。在肿瘤部位的微酸性条件下,LDH纳米片逐渐降解,使EDTA在肿瘤部位实现酸响应的可控性释放。释放出的EDTA能够螯合钙离子,引起连接肿瘤细胞的连接蛋白中钙离子的耗竭,导致肿瘤细胞分离,进而促进肿瘤细胞的解聚、清除。分离的肿瘤细胞能被LDH/EDTA包裹,阻止了其与邻近组织的再粘连,能有效预防转移。该研究作为“腔道用微纳米片再结直肠癌中的应用及临床试验”项目已稳步开启,并在晚期结直肠癌患者身上取得了较好的效果。
全文:https://pubmed.ncbi.nlm.nih.gov/35333538/

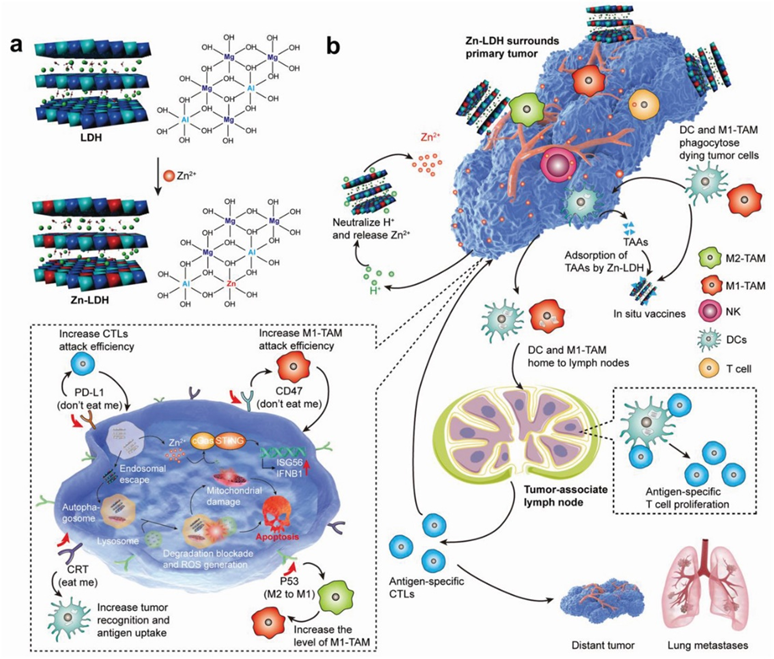
Advanced Materials:瘤周注射免疫调节佐剂诱导强大且安全的实体瘤金属免疫治疗
A Peritumorally Injected Immunomodulating Adjuvant Elicits Robust and Safe Metalloimmunotherapy against Solid Tumors
虽然疫苗佐剂与炎症细胞因子或免疫激动剂合理结合以缓解免疫抑制是一种针对实体瘤的有吸引力的治疗策略,但仍然存在不可避免的非特异性毒性。本文报道了一种基于Zn2+的层状双氢氧化物(Zn-LDH)免疫调节佐剂,不仅能缓解免疫抑制,还能引起强大的抗肿瘤免疫。瘤周注射Zn-LDH可持续中和酸性TME,释放丰富的Zn2+,促进由M1-肿瘤相关巨噬细胞、细胞毒性T细胞和自然杀伤细胞组成的促炎网络。此外,肿瘤细胞内化的Zn-LDH有效破坏内/溶酶体,阻断自噬,诱导线粒体损伤,释放的Zn2+激活cGas-STING信号通路,诱导免疫原性细胞死亡,进一步促进肿瘤相关抗原的释放,诱导抗原特异性细胞毒性T淋巴细胞。仅注射Zn-LDH佐剂,而不使用任何细胞毒性炎症细胞因子或免疫激动剂,可显著抑制小鼠实体肿瘤的生长、复发和转移。
全文:https://pubmed.ncbi.nlm.nih.gov/35986645/
参考文献:
[1] M. Xu and M. Wei , Adv. Funct. Mater., 2018, 28 , 1802943
[2] T. Hu , Z. Gu, Gareth R. W, et al. Chem. Soc. Rev., 2022,51, 6126-6176
[3] C. Hochstetter J. Prakt. Chem., 1842, 27 , 376
[4] W. Feitknecht and M. Gerber , Helv. Chim. Acta, 1942, 25 , 131
[5] S. Miyata , T. Kumura , H. Hatori and K. Tannabe , Nippon Kagaku Zasshi, 1971, 92 , 514 —519
[6] L. Wang , Y. Zhou , Y. Lin and X. Duan , Chem. Bull., 2011, 74 , 1074 —1083
[7] X. Xu , Y. Lin , D. G. Evans and X. Duan , Sci. China Chem., 2010, 53 , 1461 —1469
[8] Ameena Shirin. V. K, Sankar, R,Johnson, A. P, et al, J. Control .Release., 2021,330, 398-4262, 25 , 131